Tissue and Cell Culture tech من التقنيات المهمة في المختبر تقنية زراعة الأنسجة. حيث تستخدم في عمليات الترقيع التجميلية لعدد من إصابات الجلد كالحروق والـ melanoma والبهاق. كذلك تستخدم في عمليات استبدال الأنسجة التالفة بسبب الحوادث أوالأمراض كالأنسجة العضلية والمعوية. ومن ضمن استعمالات الأنسجة الأخرى هي دراسة نمو الخلايا و تأثير الفيروسات عليها ودراسة أطوار نمو بعض الطفيليات التي لا تنمو إلا داخل الخلايا، وتجرى أيضاً اختبارات للأدوية الجديدة وتأثيرها على أنسجة الجسم من خلال هذه المزارع الخلوية. وكما نرى لزراعة الأنسجة استخدامات متعددة ومن الخسارة أن كليتنا الحبيبة لم تقدم لنا أي كورس لدراستها ولو نظرياً لذلك دعونا نأخذ فكرة عن هذه التقنية وستكون فكرة شاملة وعامة لأنها ستختلف وتتعقد بحسب النسيج المطلوب وحسب الغرض من الزراعة والشركة المنتجة للأدوات والمحاليل.
متطلبات العمل:
Laminal flow hoods

وتعتبر ساحة العمل إذ تقوم بتعقيم الجو المحيط للمزارع من البكتريا أو الفطريات والكيماويات وكل ما من شأنه أن يلوث الخلايا المزروعة وهي على نوعين:
The vertical hood (biology safety cabinet)s
يستخدم هذا النوع للتعامل مع كائنات خطيرة لأن الرذاذ المتطاير تتم فلترته قبل أن يخرج الهواء إلى محيط العمل. وهو يضخ الهواء من الأعلى باتجاه الأسفل.
The Horizontal hoods
تقدم أفضل حماية للمزارع لأنها تضخ الهواء باتجاه الشخص الذي يعمل بشكل أفقي. يمنع تماماً استخدام هذا النوع في التجارب الكيماوية أو البكتيرية والفطرية لأنه ليس بـ fume hood.
كلا النوعين يستخدم HEPA لفلترة الهواء قبل مروره في المختبر. وهي مزودة كذلك بـ UV لتعقيم أسطح ساحة العمل، أثناء تشغيل الـ UV ينبغي التأكد من عدم وجود أي مزرعة أو عدم إدخال يد أو رأس الشخص الذي يعمل لتفادي الأضرار التي تسببها هذه الأشعة. ينبغي تشغيل الـ Hoods قبل البدء بالعمل بـ 10 – 20 دقيقة ومسح الأسطح بإيثانول قبل وبعد الاستخدام.
CO2 incubator:

المحافظة على ph للخلايا من الشروط المهمة لنجاح نمو الخلايا بشكل طبيعي لذلك فإن تركيز CO2 المستخدم يكون ما بين 5-10% لأغلب المزارع. كذلك يجب عدم إحكام غلق الـ flask ليتمكن الهواء من المرور ويسمح بتبادل الغازات وللمحافظة على الرطوبة المطلوبة لحياة الأنسجة.
Inverted phase contrast microscopes

يستخدم لمعاينة الخلايا. يجب العناية بالمايكروسكوب كالمعتاد من تغطيته عند عدم العمل مع التأكد من إطفاء أضوائه وضبط العدسات على استقامة واحدة أثناء الاستخدام وتنظيفه بالطرق التقليدية.
أوعية الزراعة (vessels):
هناك عدة أوعية تستخدم لزراعة الخلايا كـ Petri dish, micro-well plate and flasks ولكل منها أنواع مختلفة لأن الشركات تتسابق في إعطاء ميزات أكثر في أوعيتها الجديدة وتسهيل عملية نقل الخلايا بعد نموها من وعاء إلى آخر كما تتنافس في تغطية العيوب الدارجة كموت الخلايا الموجودة في زوايا الـ flasks ومنع النمو الزائد على جدران هذه الأوعية. الخلايا المثالية تكون متساوية الكثافة قدر الإمكان، أي يكون لها نفس معدل النمو ومتساوية السطح في كل المساحة المزروعة.



حفظ المزارع:
تحفظ الخلايا في نيتروجين سائل (-196 C) أو غازي ( -156 C). تجميد الخلايا يمكن أن يتسبب في قتلها بسبب تأثير الكريستالات المتكونة والتغيير في تركيز الإلكتروليتات والـ Ph والجفاف. لتفادي الآثار السيئة للتجميد نستخدم الـ glycerol أو مواد أخرى والتي تسمى بـ cryoprotective agents التي من شأنها أن تقلل نقطة التجمد.
الوسط المستخدم في التجميد freezing medium يفضل أن يكون 90% سيرم و 10% dimethyl sulfoxideيختصر بـ DMSO ويتم تغيير هذا الوسط كل 24 ساعة قبل أن يتجمد. عملية التبريد تتم ببطء من درجة حرارة الغرفة إلى -80 C بمعدل نقص بـ 1-3C / دقيقة، لتتمكن جزيئات الماء من مغادرة الخلايا وعدم الاحتباس داخلها والتسبب في انفجارها.
وعندما يحين الوقت لاستعمال الخلايا واسترجاعها من وضعها المتجمد. تؤخذ الخلايا وتوضع بسرعة في حمام مائي بدرجة حرارة 37C. في حال ذوبان الكريستالات ننقل الخلايا بالـ pipette إلى flask يحتوي على growth medium دافئ.
Maintenance
ينبغي أن تتم معاينة الخلايا يوميا لأي تغير في شكلها، ولون الوسط وكثافة الخلايا النامية وتسجيل التغيرات في log خاص يحتوي اسم الخلايا بالإضافة إلى معلومات عن مكونات الوسط وأيام فصل الخلايا وإعادة زرعها وإضافة الغذاء لها.
متطلبات المزرعة والأنسجة:
- المتطلبات الفسيولوجية:
درجة الحرارة النموذجية 37C.تركيز الهيدروجين يكون ما بين PH 7.2-7.5 مع ضبط الإسمولالية والرطوبة وتركيز الـ CO2 . كما يفضل زرع الخلايا في معزل عن الضوء لأن الوسط المستخدم قد يفرز في الضوء مركبات لها خاصية سميّة تؤثر سلباً على الخلايا.
- حاجات الوسط:
بعض الأيونات Na, K, Ca, Mg, Cl, P, or CO2 وبعض العناصر كالحديد والزنك مع الجلوكوز والأحماض الأمينية والفيتامينات مع كولين وسيرم الذي يحتوي على عدد كبير من معززات النمو للخلايا ولا ننسى إضافة المضادات الحيوية التي ليس لها علاقة بنمو الخلايا ولكن فقط لمنع نمو البكتريا والفطريات.
- تغذية الخلايا:
تكون 2-3 مرات في الأسبوع، وذلك باستبدال الوسط القديم بآخر جديد.
- قياس نمو وحيوية الخلايا:
يمكن التأكد من حيوية الخلايا باستخدام الـ inverted phase contrast microscope فالخلايا الحية تكون لامعة تحت المايكروسكوب. بالنسبة لـ suspension cells الخلايا تكون مستديرة ومتشابهة. هناك صبغات تسمى بـ vital dye التي تتراكم داخل الخلايا الميتة ولا تتمكن من النفاذ إلى الخلايا الحية. أما تقدير عدد الخلايا فيكون بـ hemocytometer.
Growth pattern
يعتمد على نوع الخلايا المزروعة وseeding density _ أي الخلايا الأولية للزراعة_ ومكونات الوسط المستخدم. كل الخلايا ستمر بمرحلة الـ exponential وفيها أكبر نشاط للخلايا في عمليات الأيض تنتقل بعدها الخلايا لمرحلة stationary phase حيث يكون عدد الخلايا ثابت وهي ميزة الـ confluent بحيث تكون كل المساحات المتاحة للنمو قد غطت بالخلايا.
حصاد النسيج (Harvesting):
نقوم بحصد الخلايا عندما تصل إلى مرحلة معينة من الكثافة تمنعها من الاستمرار بالنمو، وبشكل نموذجي يمكننا القول بأن الحصاد يتم عند الوصول إلى semi-confluent أي ما تزال في مرحلة الـ log.
تتم تغذية الخلايا ثلاث مرات في الأسبوع. نفصل الخلايا عن الوعاء إما لإعادة زرعها في وعاء آخر بغرض التخفيف أو منحها فرصة أخرى للتكاثر أو عند بلوغ الخلايا النمو والنضج المطلوبين لاستخدامها كرقعة للمريض.
يتم فصل الخلايا عن أوعيتها بعدما تصل لمرحلة semi-confluent بعدة طرق منها:
طرق ميكانيكية:
باستخدام spatula مطاطية يتم إزالة طبقة الخلايا النامية يدوياً. وهي طريقة سريعة وسهلة ولكنها قد تتسبب في تهتك الخلايا وموتها. تستخدم هذه الطريقة عندما تكون حياة الخلايا ليست مهمة كما في تحضير المستخلصات extracts.

الإنزيمات الهاضمة:
عدد من الإنزيمات تستعمل بعد إضافتها مع EDTA كـ trypsin, pronase, collagenase
هذا الخليط يتمكن من فصل الخلايا من أوعيتها. وهي طريقة سريعة وفعالة ولكنها تتسبب في قتل الخلايا الموجودة على السطح أثناء ملامستها لهذا الخليط فإنها ستقوم بهضم البروتينات الموجودة على سطح الخلايا النامية. ومن الممكن الحد من الـ proteolysis بإضافة الوسط المستخدم مع سيرم بسرعة بعد إضافة الخليط. يحتوي السيرم بصورة طبيعية على trypsin inhibitors وبذلك يتم فصل الخلايا عن الوعاء وبسرعة تتم معادلة الـ trypsin لإيقاف عمله في هضم البروتينات الموجودة.
EDTA
يمكن أن يستخدم لوحده بدون الإنزيمات ويكون أكثر لطفاً على الخلايا.
Monolayer بشكل عام تزال بستة خطوات:
- غسل الخلايا بـ buffer solution.
- معالجة الخلايا بمعامل انفصال dissociating agent.
- فحص الخلايا تحت المايكروسكوب لرؤية مستوى النمو. ثم وضع الـ flask في الـ incubator حتى تستدير الخلايا وتكون سهلة الإزالة وذلك بضرب جانب الـflask بخفة.
- تنقل الخلايا إلى أنابيب الزراعة ونضيف عليها الوسط medium مع سيرم.
- نزيل الطبقة الطافية بعد عمل spinning ثم نستبدلها بوسط جديد.
- تعد الخلايا بـ hemocytometer ثم تخفف بالوسط المطلوب للتركيز المناسب.
Hemocytometer
هو ليس جهاز بمعنى الكلمة بل شريحة مقسمة إلى 9 مربعات مساحة كل مربع 1 ملم وعمقها 1. ملم أي كل مربع يكفي لـ 0.0001ملم من السائل الذي يحتوي الخلايا. تشبه الشرائح المستخدمة في عد كريات الدم الحمراء والبيضاء.

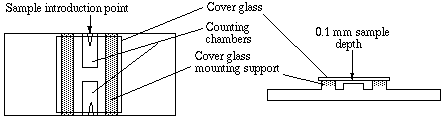
الطريقة المتبعة لعد الخلايا باستخدام الـ hemocytometer هي أن نقوم بتغطية الشريحة بـ coverslip ونضغطها بخفة حتى تظهر Newton rings "الدوائر اللي تطلع بسبب انعكاس الضوء بين سطح مستوي وجسم دائري" ونضيف الـ cell suspension كقطرة واحدة على طرف الـ cover slip وبنفس الكمية نضيف صبغة 0.4% Trypan blue ونعمل لها incubation خمس دقائق في 37C. بعد ذلك نضع الشريحة في inverted microscope ونقوم بعدّ الخلايا الغير مصبوغة. مجموع الخلايا الحية/ملم = الخلايا الحية في المربع × 10000
هذي حلقات نيوتن..

وهذي سلايد.. الدوائر الشفافة هي الحية والزرقاء ميتة:

وسائل الحماية المتبعة:
- كل المزارع نتعامل معها على أساس أنها مواد خطرة. فهي قد تحتوي على فيروسات أو عناصر غير محسوب وجودها في الخلايا مما تسبب الخطر على الشخص الذي يتعامل مع الخلايا.
- في خطوة الـ pipetting ينبغي استخدام pipette aids لمنع تهتك الخلايا أو انتشار الـ aerosols
- يمنع الأكل والشرب تماماً في المختبر، كما يلزم غسل اليدين قبل وبعد التعامل مع المزارع.
- كل الأدوات التي تم استعمالها يتم التخلص منها بالـ autoclave.
- تعقيم الأسطح والأدوات بالمعقمات والتخلص من السوائل بمعادلتها كيماوياً أو إضافة bleach للسوائل.
هذا موقع حلو فيه شرح مبسط لطريقة عمل المزارع وبالفيديو والصور
http://www.bme.gatech.edu/vcl/Tissue...ll_seeding.htm
وكالعادة الموضوع تحت تصرفكم من الزيادة والتعديل وبإذن الله أضيف عليه بعض أنواع الخلايا وكيفية التعامل معها..
__________________
متطلبات العمل:
Laminal flow hoods

وتعتبر ساحة العمل إذ تقوم بتعقيم الجو المحيط للمزارع من البكتريا أو الفطريات والكيماويات وكل ما من شأنه أن يلوث الخلايا المزروعة وهي على نوعين:
The vertical hood (biology safety cabinet)s
يستخدم هذا النوع للتعامل مع كائنات خطيرة لأن الرذاذ المتطاير تتم فلترته قبل أن يخرج الهواء إلى محيط العمل. وهو يضخ الهواء من الأعلى باتجاه الأسفل.
The Horizontal hoods
تقدم أفضل حماية للمزارع لأنها تضخ الهواء باتجاه الشخص الذي يعمل بشكل أفقي. يمنع تماماً استخدام هذا النوع في التجارب الكيماوية أو البكتيرية والفطرية لأنه ليس بـ fume hood.
كلا النوعين يستخدم HEPA لفلترة الهواء قبل مروره في المختبر. وهي مزودة كذلك بـ UV لتعقيم أسطح ساحة العمل، أثناء تشغيل الـ UV ينبغي التأكد من عدم وجود أي مزرعة أو عدم إدخال يد أو رأس الشخص الذي يعمل لتفادي الأضرار التي تسببها هذه الأشعة. ينبغي تشغيل الـ Hoods قبل البدء بالعمل بـ 10 – 20 دقيقة ومسح الأسطح بإيثانول قبل وبعد الاستخدام.
CO2 incubator:

المحافظة على ph للخلايا من الشروط المهمة لنجاح نمو الخلايا بشكل طبيعي لذلك فإن تركيز CO2 المستخدم يكون ما بين 5-10% لأغلب المزارع. كذلك يجب عدم إحكام غلق الـ flask ليتمكن الهواء من المرور ويسمح بتبادل الغازات وللمحافظة على الرطوبة المطلوبة لحياة الأنسجة.
Inverted phase contrast microscopes

يستخدم لمعاينة الخلايا. يجب العناية بالمايكروسكوب كالمعتاد من تغطيته عند عدم العمل مع التأكد من إطفاء أضوائه وضبط العدسات على استقامة واحدة أثناء الاستخدام وتنظيفه بالطرق التقليدية.
أوعية الزراعة (vessels):
هناك عدة أوعية تستخدم لزراعة الخلايا كـ Petri dish, micro-well plate and flasks ولكل منها أنواع مختلفة لأن الشركات تتسابق في إعطاء ميزات أكثر في أوعيتها الجديدة وتسهيل عملية نقل الخلايا بعد نموها من وعاء إلى آخر كما تتنافس في تغطية العيوب الدارجة كموت الخلايا الموجودة في زوايا الـ flasks ومنع النمو الزائد على جدران هذه الأوعية. الخلايا المثالية تكون متساوية الكثافة قدر الإمكان، أي يكون لها نفس معدل النمو ومتساوية السطح في كل المساحة المزروعة.



حفظ المزارع:
تحفظ الخلايا في نيتروجين سائل (-196 C) أو غازي ( -156 C). تجميد الخلايا يمكن أن يتسبب في قتلها بسبب تأثير الكريستالات المتكونة والتغيير في تركيز الإلكتروليتات والـ Ph والجفاف. لتفادي الآثار السيئة للتجميد نستخدم الـ glycerol أو مواد أخرى والتي تسمى بـ cryoprotective agents التي من شأنها أن تقلل نقطة التجمد.
الوسط المستخدم في التجميد freezing medium يفضل أن يكون 90% سيرم و 10% dimethyl sulfoxideيختصر بـ DMSO ويتم تغيير هذا الوسط كل 24 ساعة قبل أن يتجمد. عملية التبريد تتم ببطء من درجة حرارة الغرفة إلى -80 C بمعدل نقص بـ 1-3C / دقيقة، لتتمكن جزيئات الماء من مغادرة الخلايا وعدم الاحتباس داخلها والتسبب في انفجارها.
وعندما يحين الوقت لاستعمال الخلايا واسترجاعها من وضعها المتجمد. تؤخذ الخلايا وتوضع بسرعة في حمام مائي بدرجة حرارة 37C. في حال ذوبان الكريستالات ننقل الخلايا بالـ pipette إلى flask يحتوي على growth medium دافئ.
Maintenance
ينبغي أن تتم معاينة الخلايا يوميا لأي تغير في شكلها، ولون الوسط وكثافة الخلايا النامية وتسجيل التغيرات في log خاص يحتوي اسم الخلايا بالإضافة إلى معلومات عن مكونات الوسط وأيام فصل الخلايا وإعادة زرعها وإضافة الغذاء لها.
متطلبات المزرعة والأنسجة:
- المتطلبات الفسيولوجية:
درجة الحرارة النموذجية 37C.تركيز الهيدروجين يكون ما بين PH 7.2-7.5 مع ضبط الإسمولالية والرطوبة وتركيز الـ CO2 . كما يفضل زرع الخلايا في معزل عن الضوء لأن الوسط المستخدم قد يفرز في الضوء مركبات لها خاصية سميّة تؤثر سلباً على الخلايا.
- حاجات الوسط:
بعض الأيونات Na, K, Ca, Mg, Cl, P, or CO2 وبعض العناصر كالحديد والزنك مع الجلوكوز والأحماض الأمينية والفيتامينات مع كولين وسيرم الذي يحتوي على عدد كبير من معززات النمو للخلايا ولا ننسى إضافة المضادات الحيوية التي ليس لها علاقة بنمو الخلايا ولكن فقط لمنع نمو البكتريا والفطريات.
- تغذية الخلايا:
تكون 2-3 مرات في الأسبوع، وذلك باستبدال الوسط القديم بآخر جديد.
- قياس نمو وحيوية الخلايا:
يمكن التأكد من حيوية الخلايا باستخدام الـ inverted phase contrast microscope فالخلايا الحية تكون لامعة تحت المايكروسكوب. بالنسبة لـ suspension cells الخلايا تكون مستديرة ومتشابهة. هناك صبغات تسمى بـ vital dye التي تتراكم داخل الخلايا الميتة ولا تتمكن من النفاذ إلى الخلايا الحية. أما تقدير عدد الخلايا فيكون بـ hemocytometer.
Growth pattern
يعتمد على نوع الخلايا المزروعة وseeding density _ أي الخلايا الأولية للزراعة_ ومكونات الوسط المستخدم. كل الخلايا ستمر بمرحلة الـ exponential وفيها أكبر نشاط للخلايا في عمليات الأيض تنتقل بعدها الخلايا لمرحلة stationary phase حيث يكون عدد الخلايا ثابت وهي ميزة الـ confluent بحيث تكون كل المساحات المتاحة للنمو قد غطت بالخلايا.
حصاد النسيج (Harvesting):
نقوم بحصد الخلايا عندما تصل إلى مرحلة معينة من الكثافة تمنعها من الاستمرار بالنمو، وبشكل نموذجي يمكننا القول بأن الحصاد يتم عند الوصول إلى semi-confluent أي ما تزال في مرحلة الـ log.
تتم تغذية الخلايا ثلاث مرات في الأسبوع. نفصل الخلايا عن الوعاء إما لإعادة زرعها في وعاء آخر بغرض التخفيف أو منحها فرصة أخرى للتكاثر أو عند بلوغ الخلايا النمو والنضج المطلوبين لاستخدامها كرقعة للمريض.
يتم فصل الخلايا عن أوعيتها بعدما تصل لمرحلة semi-confluent بعدة طرق منها:
طرق ميكانيكية:
باستخدام spatula مطاطية يتم إزالة طبقة الخلايا النامية يدوياً. وهي طريقة سريعة وسهلة ولكنها قد تتسبب في تهتك الخلايا وموتها. تستخدم هذه الطريقة عندما تكون حياة الخلايا ليست مهمة كما في تحضير المستخلصات extracts.

الإنزيمات الهاضمة:
عدد من الإنزيمات تستعمل بعد إضافتها مع EDTA كـ trypsin, pronase, collagenase
هذا الخليط يتمكن من فصل الخلايا من أوعيتها. وهي طريقة سريعة وفعالة ولكنها تتسبب في قتل الخلايا الموجودة على السطح أثناء ملامستها لهذا الخليط فإنها ستقوم بهضم البروتينات الموجودة على سطح الخلايا النامية. ومن الممكن الحد من الـ proteolysis بإضافة الوسط المستخدم مع سيرم بسرعة بعد إضافة الخليط. يحتوي السيرم بصورة طبيعية على trypsin inhibitors وبذلك يتم فصل الخلايا عن الوعاء وبسرعة تتم معادلة الـ trypsin لإيقاف عمله في هضم البروتينات الموجودة.
EDTA
يمكن أن يستخدم لوحده بدون الإنزيمات ويكون أكثر لطفاً على الخلايا.
Monolayer بشكل عام تزال بستة خطوات:
- غسل الخلايا بـ buffer solution.
- معالجة الخلايا بمعامل انفصال dissociating agent.
- فحص الخلايا تحت المايكروسكوب لرؤية مستوى النمو. ثم وضع الـ flask في الـ incubator حتى تستدير الخلايا وتكون سهلة الإزالة وذلك بضرب جانب الـflask بخفة.
- تنقل الخلايا إلى أنابيب الزراعة ونضيف عليها الوسط medium مع سيرم.
- نزيل الطبقة الطافية بعد عمل spinning ثم نستبدلها بوسط جديد.
- تعد الخلايا بـ hemocytometer ثم تخفف بالوسط المطلوب للتركيز المناسب.
Hemocytometer
هو ليس جهاز بمعنى الكلمة بل شريحة مقسمة إلى 9 مربعات مساحة كل مربع 1 ملم وعمقها 1. ملم أي كل مربع يكفي لـ 0.0001ملم من السائل الذي يحتوي الخلايا. تشبه الشرائح المستخدمة في عد كريات الدم الحمراء والبيضاء.


الطريقة المتبعة لعد الخلايا باستخدام الـ hemocytometer هي أن نقوم بتغطية الشريحة بـ coverslip ونضغطها بخفة حتى تظهر Newton rings "الدوائر اللي تطلع بسبب انعكاس الضوء بين سطح مستوي وجسم دائري" ونضيف الـ cell suspension كقطرة واحدة على طرف الـ cover slip وبنفس الكمية نضيف صبغة 0.4% Trypan blue ونعمل لها incubation خمس دقائق في 37C. بعد ذلك نضع الشريحة في inverted microscope ونقوم بعدّ الخلايا الغير مصبوغة. مجموع الخلايا الحية/ملم = الخلايا الحية في المربع × 10000
هذي حلقات نيوتن..

وهذي سلايد.. الدوائر الشفافة هي الحية والزرقاء ميتة:

وسائل الحماية المتبعة:
- كل المزارع نتعامل معها على أساس أنها مواد خطرة. فهي قد تحتوي على فيروسات أو عناصر غير محسوب وجودها في الخلايا مما تسبب الخطر على الشخص الذي يتعامل مع الخلايا.
- في خطوة الـ pipetting ينبغي استخدام pipette aids لمنع تهتك الخلايا أو انتشار الـ aerosols
- يمنع الأكل والشرب تماماً في المختبر، كما يلزم غسل اليدين قبل وبعد التعامل مع المزارع.
- كل الأدوات التي تم استعمالها يتم التخلص منها بالـ autoclave.
- تعقيم الأسطح والأدوات بالمعقمات والتخلص من السوائل بمعادلتها كيماوياً أو إضافة bleach للسوائل.
هذا موقع حلو فيه شرح مبسط لطريقة عمل المزارع وبالفيديو والصور
http://www.bme.gatech.edu/vcl/Tissue...ll_seeding.htm
وكالعادة الموضوع تحت تصرفكم من الزيادة والتعديل وبإذن الله أضيف عليه بعض أنواع الخلايا وكيفية التعامل معها..
__________________







